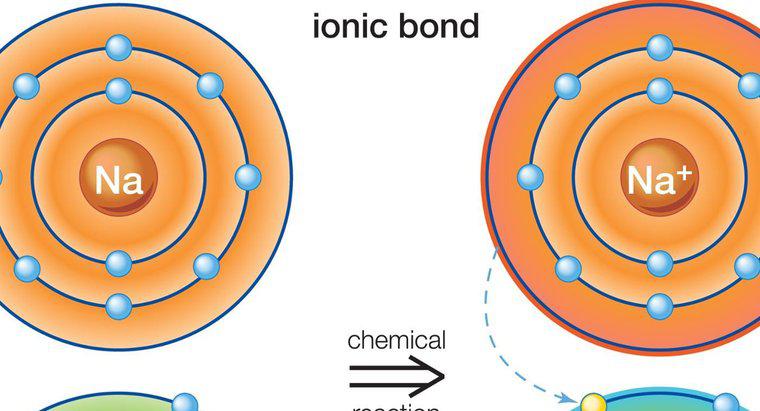
Liên kết ion liên quan đến kim loại và phi kim loại. Điều này là do liên kết ion liên quan đến sự chuyển các electron hóa trị. Liên kết kết quả tạo ra hai ion mang điện trái dấu.
Liên kết ion xảy ra giữa kim loại và phi kim loại vì kim loại có ít electron ở vòng ngoài cùng. Điều này làm cho kim loại sẵn sàng hơn để mất điện tử, vì điều đó sẽ dẫn đến việc ion thu được cấu hình ổn định. Một số phi kim loại có gần 8 electron và cần nhiều electron hơn để có được cấu hình khí quý.
Nhiều hơn một electron có thể được chia sẻ giữa các nguyên tố. Khi một phần tử tăng và một phần tử khác mất đi, điều này dẫn đến một phần tử trở nên tích điện dương và phần tử kia mang điện tích âm. Việc nguyên tố trở nên tích cực hay tiêu cực phụ thuộc vào việc chúng bị mất hay nhận được electron. Một sự mất mát sẽ dẫn đến một điện tích dương, trong khi một điện tử bổ sung dẫn đến một điện tích âm. Điện tích thực trong hợp chất phải bằng không. Vì kim loại luôn nhường electron nên nguyên tố kim loại là dương và nguyên tố phi kim là âm.
Một ví dụ về liên kết ion là hợp chất natri clorua, thường được gọi là muối ăn. Natri chứa một điện tử ở vòng ngoài cùng của nó, trong khi clo chứa bảy. Natri chuyển điện tử của nó cho clo và trở nên tích điện dương, trong khi clo trở nên tích điện âm. Điện tích thực của hợp chất bằng không, vì hai nguyên tố đã liên kết với nhau.