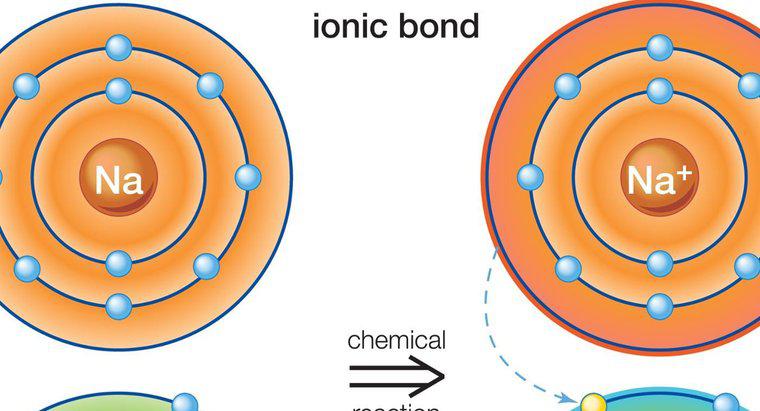
Việc đặt tên các hợp chất ion đòi hỏi phải xác định chính xác các loại cation và anion có mặt. Trong một số trường hợp nhất định, điện tích của ion rất quan trọng để đặt tên chính xác.
Các nguyên tắc đặt tên hóa học tiêu chuẩn xác định cation đầu tiên trong tên và anion thứ hai. Trong các hợp chất ion, cation thường là một kim loại và phần đầu tiên của tên hợp chất chỉ đơn giản là kim loại đó. Nếu cation có thể tồn tại tự nhiên ở nhiều trạng thái tích điện, điện tích của kim loại, còn được gọi là hóa trị, phải được xác định trong tên ghép bằng các chữ số La Mã. Ví dụ, sắt có thể tồn tại ở trạng thái hai điện tích dương hoặc ba điện tích dương. Chúng sẽ được đặt tên lần lượt là sắt (II) và sắt (III).
Bước cuối cùng trong việc đặt tên một hợp chất ion là xác định đúng anion có mặt. Các anion có thể là một ion đơn lẻ, chẳng hạn như bromua, hoặc các phân tử phức tạp được tạo thành từ nhiều nguyên tử, chẳng hạn như sunfat. Đối với các anion phức tạp này, các tham số đặt tên bổ sung được đặt ra. Các nguyên tố có thể tạo thành nhiều oxyanion, chẳng hạn như nitơ và lưu huỳnh, có kết thúc là -ite hoặc -ate, tùy thuộc vào số lượng phân tử oxy có mặt. Một ví dụ về hợp chất ion được đặt tên đúng là sắt (II) sunfat có công thức ion Fe (SO4).