Điện tích tổng thể hoặc điện tích thực của bất kỳ hợp chất ion nào phải bằng không. Mặc dù bản thân các ion dương (cation) hoặc âm (anion) theo định nghĩa, cách duy nhất chúng có thể liên kết với nhau và tạo thành hợp chất bằng cách tìm kiếm một điện tích trái dấu.
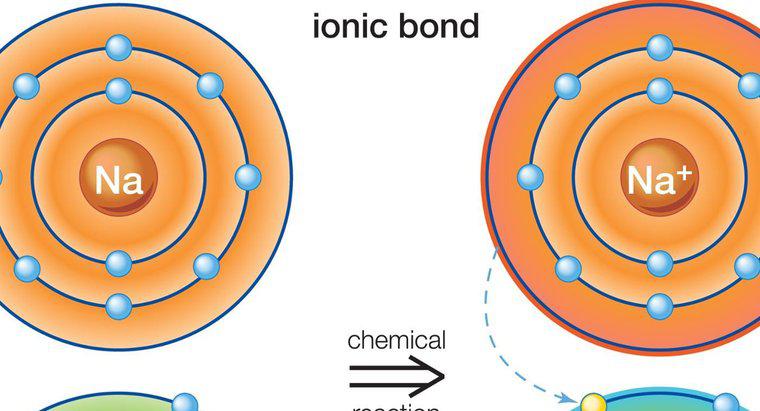
Hợp chất ion trong hóa học đề cập đến bất kỳ hợp chất hóa học nào trong đó các ion được giữ lại với nhau hoặc liên kết với nhau thông qua liên kết ion. Liên kết ion, theo định nghĩa, là lực hút tĩnh điện giữa hai ion mang điện tích trái dấu. Nói cách khác, liên kết ion chỉ có thể hình thành giữa cation và anion.
Mặc dù không có giới hạn về số lượng ion có trong một hợp chất ion, nhưng để hợp chất vẫn còn nguyên vẹn, điện tích thực cần phải bằng 0. Do đó, phải có một số lượng bằng nhau của các cation và anion trong hợp chất hoàn chỉnh.
Một ví dụ phổ biến và thông dụng về hợp chất ion thể hiện nguyên tắc này là muối ăn hoặc natri clorua, có công thức hóa học là NaCl. Sự hình thành muối ăn là kết quả của liên kết ion giữa cation natri, Na + và anion clo, Cl-. Cấu trúc của mỗi ion khác với nguyên tử của cùng một nguyên tố (Na hoặc Cl) giữ điện tích trung hòa do số proton và electron bằng nhau. Chỉ khi mỗi nguyên tử trở thành ion thì nó mới có thể liên kết với nguyên tử kia và tạo ra hợp chất ion.