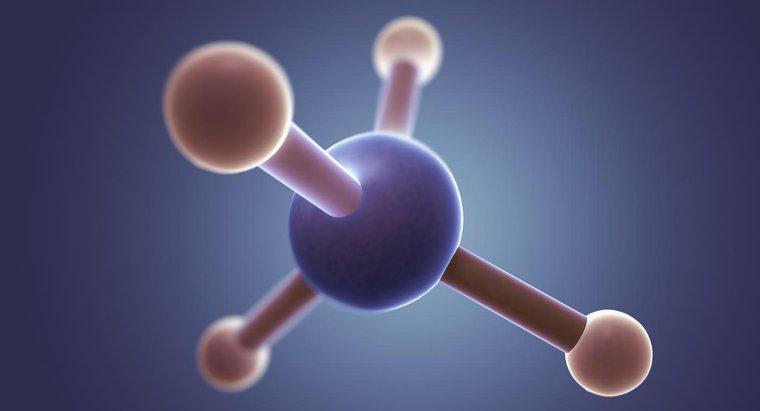
Cấu trúc Lewis của CS2 bao gồm một nguyên tử cacbon duy nhất với một nguyên tử lưu huỳnh ở mỗi bên. Các liên kết trong cấu trúc Lewis hoặc là một liên kết đôi nối nguyên tử cacbon với mỗi nguyên tử lưu huỳnh, hoặc một nguyên tử lưu huỳnh kết nối với một liên kết ba và nguyên tử kia với một liên kết đơn.
Cấu trúc Lewis cho các phân tử thường được viết qua quá trình thử và sai trừ khi chúng đã được biết trước. Phương pháp để tìm ra cấu trúc Lewis yêu cầu tất cả các điện tử hóa trị phải được tính đến và tất cả các nguyên tử trong cấu trúc đều có một lớp vỏ đầy đủ các điện tử hóa trị.
Đầu tiên, kết nối tất cả các nguyên tử bằng cách sử dụng độ âm điện của các nguyên tố để xác định nguyên tử nào đi về đâu. Thông thường, nếu bạn có một nguyên tử cacbon và một số nguyên tử khác, nguyên tử cacbon sẽ nằm ở trung tâm. Trong trường hợp của CS2, nguyên tử cacbon có độ âm điện nhỏ hơn và tạo thành trung tâm.
Tiếp theo, xác định có bao nhiêu electron. Trong CS2, mỗi nguyên tử lưu huỳnh đóng góp sáu điện tử hóa trị và nguyên tử cacbon đóng góp bốn trong tổng số mười sáu. Cần 24 electron để cung cấp cho cả ba nguyên tử có lớp vỏ hóa trị đầy đủ là 8 electron. Điều này có nghĩa là phân tử CS2 phải có tổng cộng 8 liên kết nối ba nguyên tử.