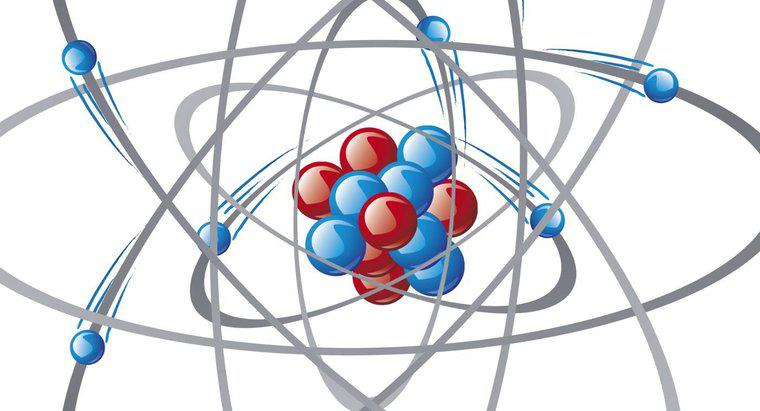
Một ion clorua có tổng số 18 điện tử. Ion clorua có thêm một điện tử để hoàn thành lớp vỏ điện tử ngoài cùng hay còn gọi là lớp vỏ hóa trị của nguyên tử.
Clo là một nguyên tố phản ứng mạnh, do lớp vỏ ngoài cùng của các electron. Các electron lấp đầy các vòng, được gọi là vỏ, bên ngoài nguyên tử. Lớp vỏ đầu tiên, gần nguyên tử nhất, chứa hai electron. Mỗi lớp sau lớp vỏ ban đầu đó chứa tối đa tám điện tử, và mỗi nguyên tử có các vòng để chứa tất cả các điện tử, nhưng không còn nữa. Clo có 17 electron; do đó, vòng thứ nhất được lấp đầy bởi hai điện tử, vòng thứ hai được lấp đầy bởi tám điện tử, nhưng chỉ có bảy điện tử cho vòng thứ ba. Điều này làm cho lớp vỏ hóa trị của clo không hoàn chỉnh, và nguyên tử thu hút các điện tử "lỏng lẻo" đến lớp vỏ này để hoàn thành nó, do đó nguyên tử có thể ổn định. Clorid là một nguyên tử clo, đã tìm ra electron cuối cùng đó và thêm nó vào lớp vỏ hóa trị ngoài cùng để trở nên bền vững. Điện tử được thêm vào này mang lại cho ion clorua một điện tích âm và do đó được coi là một anion.