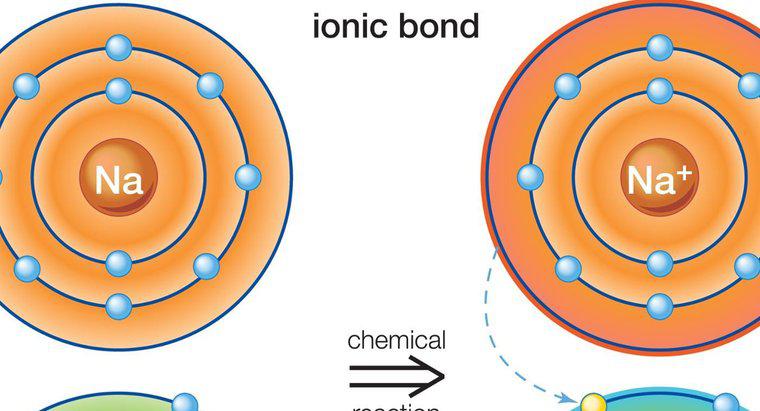
Dung dịch nước của các hợp chất ion là chất dẫn điện tốt trong khi dung dịch của các hợp chất phân tử thì không. Điều này đúng vì các ion riêng lẻ trong hợp chất ion có thể phân ly hoàn toàn trong nước với các phân tử còn lại là nguyên vẹn. Các hợp chất ion và phân tử cũng ảnh hưởng đến điểm sôi và điểm nóng chảy của nước.
Các hợp chất ion dễ hòa tan trong nước hơn các hợp chất phân tử, mặc dù có những ngoại lệ đối với quy tắc này. Nước được sử dụng làm tiêu chuẩn để xác định độ hòa tan của một hợp chất vì nó có tính phân cực cao và có thể hòa tan nhiều hợp chất hơn bất kỳ dung môi nào khác, khiến nó được mệnh danh là dung môi phổ quát. Các hợp chất ion dẫn điện khi chúng phân ly vì chúng tạo điều kiện cho sự chuyển electron. Sự khác biệt về điện tích của các hạt cho phép các điện tử tự do nhảy từ hạt này sang hạt khác một cách dễ dàng. Các phân tử chia sẻ các điện tử của chúng và có tổng điện tích trung hòa không cho phép dẫn điện nhiều.
Các hợp chất ion có nhiệt độ nóng chảy và nhiệt độ sôi cao trong khi các hợp chất phân tử có nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp. Những đặc tính này chuyển sang nước khi các hợp chất hòa tan trong nó. Các hợp chất ion phân ly làm tăng điểm nóng chảy và giảm điểm đóng băng của nước. Các hợp chất phân tử thường có tác dụng ngược lại nếu chúng hòa tan trong nước.