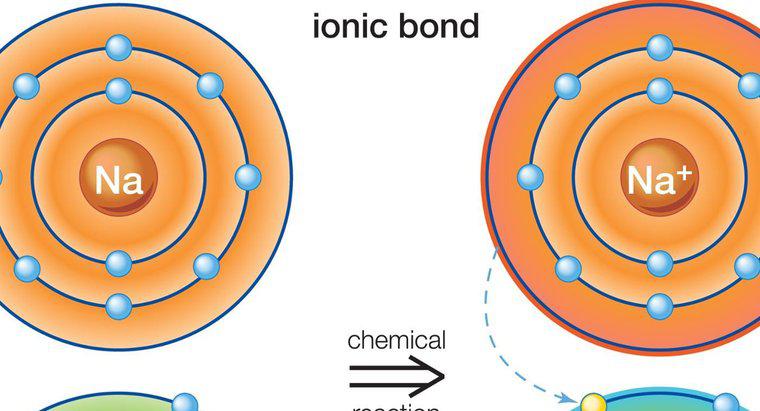
Liên kết ion xảy ra khi có mặt của một ion dương và một ion âm. Các ion được hình thành khi các nguyên tử trung hòa bị mất hoặc nhận được một điện tử. Tất cả các nguyên tử hoặc mất hoặc thêm electron để đạt được cấu hình electron ổn định. Các khí cao quý, ổn định nhất, đều có 8 electron ở lớp vỏ ngoài cùng của chúng, ngoại trừ helium, chỉ có 2 electron. Khi một nguyên tử có 8 electron ở lớp vỏ ngoài cùng, nó được cho là có cấu trúc octet ổn định.
Các kim loại có một đến ba điện tử ở lớp vỏ ngoài cùng của chúng, điều này ngăn chúng hình thành cấu trúc octet ổn định. Các nguyên tử mất điện tử sẽ dễ dàng để lộ ra một lớp vỏ bên dưới với tám điện tử, hơn là giành được điện tử để hoàn thành cấu trúc octet. Do đó, kim loại tạo thành các ion dương. Tuy nhiên, các phi kim loại có xu hướng thu được một hoặc nhiều electron để hoàn thành octet ở lớp vỏ ngoài cùng của chúng và do đó có xu hướng tạo thành các ion âm.
Các kim loại có thể tặng các electron của chúng cho các phi kim loại. Vì điện tích của các ion không giống nhau (các ion mang điện trái dấu), nguyên tử kim loại mang điện tích dương được giữ nguyên tử phi kim loại mang điện tích âm với lực hút tĩnh điện mạnh.