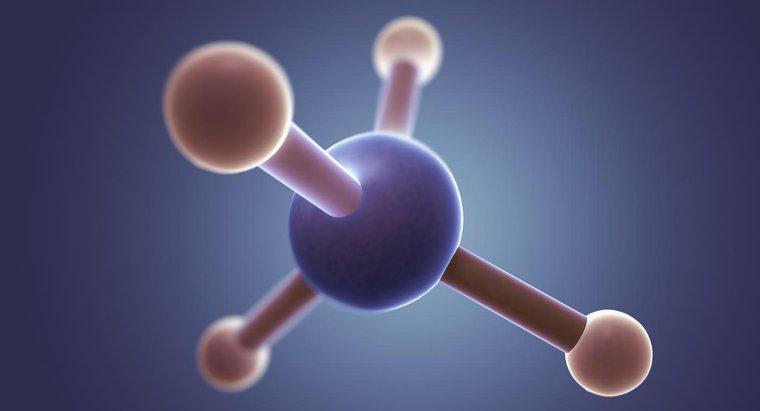
Cấu trúc Lewis của CH3Br có cacbon ở trung tâm với bốn điện tử xung quanh nó và ba hydro và brom mỗi loại chia sẻ một điện tử duy nhất với cacbon. Brom có thêm ba cặp điện tử bao quanh nó.
Cấu trúc Lewis cho thấy cách các nguyên tử liên kết với nhau để tạo thành một phân tử hoàn chỉnh và chúng rất hữu ích để chứng minh liên kết trong các phân tử cơ bản, chẳng hạn như bromomethane. Trong một số trường hợp, các đường kẻ được sử dụng để biểu thị các liên kết, nhưng các dấu chấm thường phổ biến hơn khi xử lý các hợp chất cơ bản. Ngoài các điện tử liên kết, các sơ đồ này cũng cho thấy các điện tử không liên kết, chẳng hạn như trong trường hợp của brom trong bromomethane. Trong trường hợp này, brom có ba cặp electron không tham gia tích cực vào liên kết giữa nó và cacbon.
Nói chung, cấu trúc Lewis chứng minh rằng hầu hết các nguyên tử, ngoại trừ hydro, tạo thành các phân tử để có tổng cộng tám điện tử ở lớp vỏ ngoài cùng của chúng. Tuy nhiên, những cấu trúc này cũng có thể được sử dụng để gợi ý về hình dạng tổng thể của một phân tử. Trong trường hợp của bromomethane, bốn nguyên tử xung quanh carbon phải được sắp xếp khá đồng đều trong không gian 3D, do đó chúng tạo thành cấu trúc tứ diện. Tuy nhiên, bởi vì brom tạo thành một liên kết dài (và do đó yếu hơn), các hydro có không gian nhiều hơn một chút so với trong metan, dẫn đến một hình tứ diện hơi méo mó.