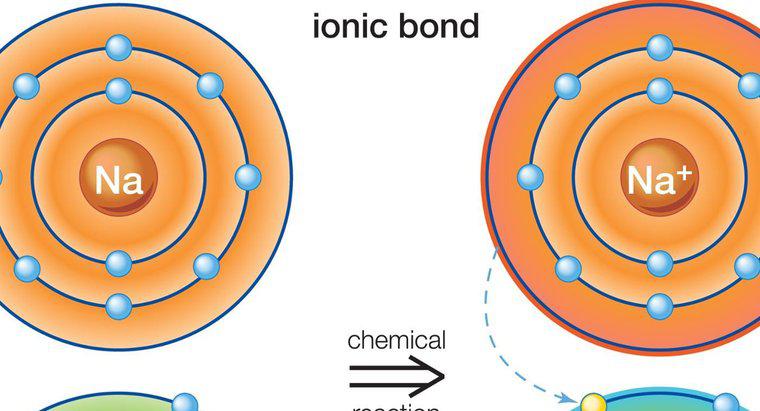
Vì chúng là kết quả của lực hút giữa các điện tích riêng phần chứ không phải là điện tích toàn phần, liên kết hydro yếu hơn nhiều so với liên kết ion hoặc liên kết cộng hóa trị. Liên kết ion và cộng hóa trị thu hút các nguyên tử của các chất khác nhau lại với nhau để hình thành các phân tử của hợp chất, trong khi liên kết hydro là lực có xu hướng hút các phân tử vào nhau. Một ví dụ về liên kết hydro là lực hút giữa các phân tử nước riêng lẻ trong khi lực hút giữa các nguyên tử hydro và oxy trong mỗi phân tử nước thể hiện liên kết cộng hóa trị.
Liên kết hydro được hình thành khi nguyên tử hydro phân cực dương trong một phân tử bị hút vào một nguyên tử có độ âm điện cao trong phân tử khác. Trong ví dụ về phân tử nước, nguyên tử oxy tích điện âm trong một phân tử nước hút nguyên tử hydro tích điện dương trong phân tử nước khác. Các nguyên tử oxy có xu hướng đánh cắp các điện tử khỏi các nguyên tử hydro trong phân tử. Khi điều này xảy ra trong phân tử nước, sự mất điện tử sẽ tạo ra một nguyên tử hydro có điện tích dương một phần, sau đó nguyên tử này bị hút vào nguyên tử oxy mang điện tích âm trong một phân tử nước khác.
Các liên kết hydro hình thành giữa các phân tử nước khiến chúng dính vào nhau. Điều này làm cho nước có nhiệt độ sôi cao vì cần phải có một mức nhiệt năng lớn hơn để phá vỡ các liên kết hydro giữa các phân tử. Nhiều chất hữu cơ cần thiết để duy trì sự sống, chẳng hạn như axit nucleic và protein, có chứa liên kết hydro. Mặc dù những liên kết này yếu hơn liên kết ion hoặc liên kết cộng hóa trị bên trong tồn tại giữa các nguyên tử trong phân tử, nhưng độ bền tích lũy của liên kết hydro trong cơ thể sống là rất đáng kể và đóng một vai trò quan trọng trong việc duy trì sự ổn định.