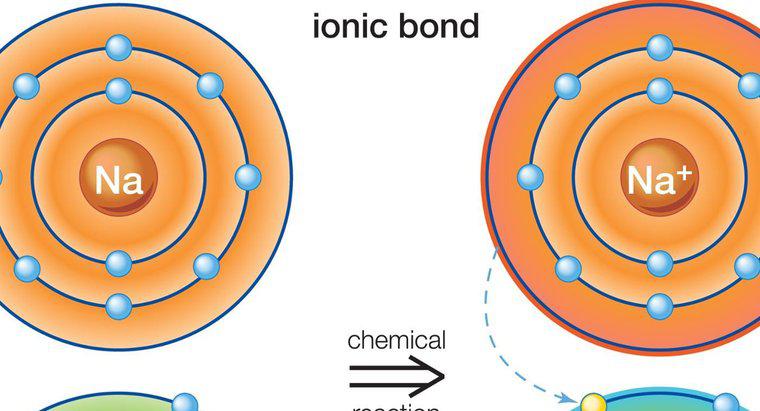
Các hợp chất ion và phân tử chủ yếu khác nhau về cách chúng được hình thành. Các hợp chất ion hình thành thông qua sự chuyển electron, trong khi các hợp chất phân tử hình thành do sự chia sẻ electron.
Các hợp chất ion chứa các nguyên tử và phân tử có điện tích trái dấu. Chúng liên kết với nhau do các điện tích trái dấu của chúng. Ví dụ, một liên kết ion cặp âm với một ion dương. Các nguyên tử và phân tử có điện tích tương tự đẩy nhau. Các phân tử mang điện tích dương được gọi là cation, và phân tử mang điện tích âm được gọi là anion. Hợp chất ion
Các hợp chất ion hình thành do các nguyên tử hoặc phân tử thu hút thêm các nguyên tử hoặc phân tử có điện tích trái dấu. Thành phần thay đổi tùy thuộc vào loại hợp chất, nhưng tất cả các hợp chất ion phải có điện tích trung hòa. Điều đó có nghĩa là chúng phải có tỷ lệ phân tử anion và cation bằng nhau.
Các hợp chất ion thường là chất rắn. Chúng có thể được tạo ra từ các nguyên tử đơn lẻ, được gọi là các hợp chất đơn nguyên, hoặc nhiều nguyên tử, điều này làm cho chúng trở thành các hợp chất đa nguyên tử. Liên kết ion, hình thành các phân tử ion, liên quan đến việc chuyển các electron từ kim loại sang phi kim loại. Các kim loại có xu hướng dễ dàng mất các điện tử dương vì chúng có ít điện tử trong mức năng lượng bên ngoài của chúng. Các phi kim loại có nhiều electron âm hơn ở mức năng lượng bên ngoài của chúng. Kết quả là chúng tìm kiếm các ion dương và liên kết tự nhiên với các phân tử kim loại. Hầu hết các hợp chất đa nguyên tử là anion, ngoại trừ cation amoni. Hợp chất ion khác với hợp chất phân tử ở chỗ chúng có thể hình thành từ kim loại và phi kim loại, trong khi hợp chất phân tử chỉ có thể hình thành từ phi kim loại. Các loại hợp chất ion phổ biến là muối và đường.
Hợp chất phân tử
Các hợp chất phân tử, còn được gọi là các hợp chất cộng hóa trị, chia sẻ các electron bằng cách hình thành các liên kết cộng hóa trị. Trong khi các hợp chất ion có thể bao gồm các nguyên tử và phân tử kim loại và phi kim loại, liên kết cộng hóa trị chỉ có thể hình thành từ các nguyên tử và phân tử phi kim loại. Hợp chất cộng hóa trị được hình thành khi các nguyên tử trong các nguyên tố khác nhau được kết hợp thông qua các phân tử. Liên kết này cho phép chia sẻ các electron hóa trị, tạo ra lực hút chung giữ các nguyên tử trong phân tử lại với nhau.
Các hợp chất cộng hóa trị có kích thước khác nhau đáng kể. Một số nhỏ, chỉ với một vài nguyên tố, trong khi những nguyên tố khác có thể có hàng nghìn nguyên tử. Bởi vì chúng chia sẻ các điện tử thay vì trao đổi chúng, các hợp chất cộng hóa trị có các tính chất khác biệt đáng kể so với các hợp chất ion. Các hợp chất cộng hóa trị có xu hướng dễ cháy, trong khi các hợp chất ion thì không. Ngược lại với các hợp chất ion, chúng không tan trong nước. Một sự phân biệt khác giữa hai loại phân tử là các hợp chất cộng hóa trị không thể dẫn điện, nhưng các hợp chất ion nói chung thì có thể. Ở nhiệt độ phòng, hầu hết các hợp chất cộng hóa trị ở dạng lỏng hoặc khí thay vì xuất hiện dưới dạng chất rắn. Điều này là do thực tế là các phân tử riêng lẻ của chúng dễ dàng tách ra hơn các phân tử trong tinh thể, điều này khiến chúng có nhiệt độ sôi tương đối thấp. Các hợp chất phân tử đơn giản có cấu tạo trùng tên. Chúng được tìm thấy trong bảng tuần hoàn bằng cách đặt tên cho nguyên tố xuất hiện xa nhất bên trái trên bảng trước, sau đó thêm "Ide" vào nguyên tố được đặt tên thứ hai và sử dụng các tiền tố để xác định số nguyên tử trong mỗi nguyên tố. Protein và cacbohydrat là hai ví dụ về các hợp chất phân tử. Các hợp chất phân tử khác bao gồm khí mêtan, oxit nitơ và natri clorua.