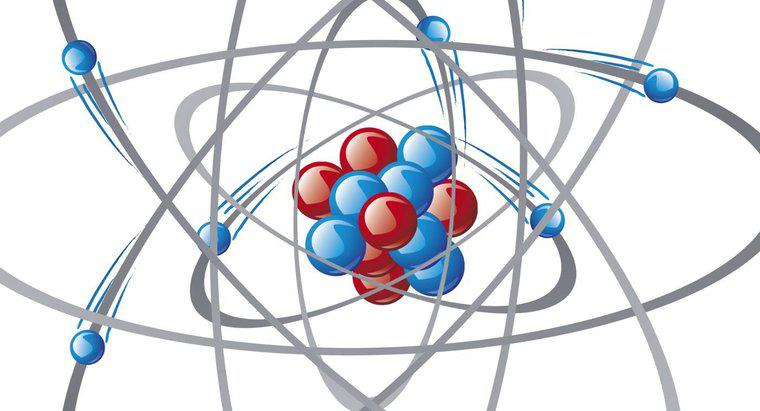
Đối với mỗi electron mà một cation hiến tặng, nó nhận một điện tích dương hoặc 1+. Đối với mỗi electron mà một anion nhận vào, nó nhận một điện tích âm, hoặc 1-. Số lượng electron mà một nguyên tử sẵn sàng tặng hoặc nhận thường có thể được xác định bởi vị trí của nguyên tố trên bảng tuần hoàn. Nhóm 1A gồm các kim loại kiềm, chúng tặng một electron độc thân cho điện tích 1+. Các kim loại kiềm thổ trong nhóm 2A mất hai electron vì điện tích 2+. Nhôm mất ba electron cho điện tích 3+. Các kim loại chuyển tiếp, hoặc các thành viên họ B của bảng tuần hoàn, có thể khó xác định hơn. Nhiều nguyên tố trong số này có thể mất đi một số lượng điện tử khác nhau, vì vậy chúng có thể tạo thành hai hoặc nhiều biến thể cation.
Số lượng electron mà một phi kim hay anion sẵn sàng nhận phụ thuộc vào số lượng electron hóa trị của nó. Các điện tử hóa trị là những điện tử ở lớp vỏ ngoài cùng của nguyên tử, và nguyên tử ổn định nhất với tổng số tám điện tử hóa trị. Để đạt được điều này, họ chấp nhận electron được tặng từ các cation. Các halogen ở nhóm 7A của bảng tuần hoàn có bảy electron hóa trị. Chúng chấp nhận một electron cho một điện tích 1-. Các anion nhóm 6A nhận hai electron cho điện tích 2-. Các nguyên tố nhóm 5A nhận ba electron cho điện tích 3-. Các nguyên tố trong Nhóm 8A là khí quý và đã có đầy đủ lớp vỏ electron hóa trị và do đó không phản ứng.