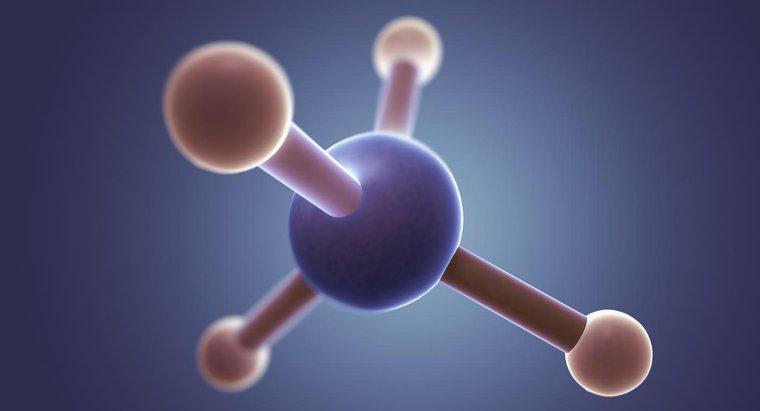
Cấu trúc của phân tử amoniac bao gồm một nguyên tử nitơ được bao quanh bởi ba nguyên tử hydro trong một hình học phân tử hình chóp tam giác. Amoniac được ký hiệu là NH 3 trong công thức và là còn được gọi là khí amoniac, nitro-sil, Spirit of Hartshorn, amoniac khan, amoniac thơm và hơi nước. Trọng lượng phân tử của nó là 17,0305.
Amoniac là một chất khí không màu, có mùi hắc. Nó có nguồn gốc tự nhiên và thông qua quá trình sản xuất. Từ tự nhiên, nó được tạo ra từ sự phân hủy của sinh vật, vi khuẩn và chất thải động vật. Nó cung cấp nguồn nitơ cho động vật và thực vật, xuất hiện tự nhiên trong không khí, nước và đất.
Amoniac được sản xuất thường được sử dụng nhiều nhất trong phân bón. Các ứng dụng sản xuất khác bao gồm:
- thuốc trừ sâu
- bột giấy và giấy
- chất nổ
- sợi tổng hợp
- có mùi muối
- sản phẩm làm sạch
- pin nhiên liệu
- nhiên liệu tên lửa
- các hóa chất khác, chẳng hạn như axit nitric và xyanua
Amoniac cũng được sử dụng trong các ngành công nghiệp khác nhau:
- Xử lý kim loại và xử lý nước bằng clo.
- Công nghiệp cao su: được sử dụng để ổn định mủ thô.
- Ngành dầu khí: bảo vệ thiết bị.
- Canh tác cây có múi: áp dụng cho cam, chanh và bưởi được bảo quản trong kho để chống nấm.
Amoniac cũng có thể được sử dụng làm chất làm lạnh trong các cơ sở chế biến thịt, cá và gia cầm; nhà máy sữa và kem; nhà máy bia và nhà máy rượu; cơ sở chế biến đồ ăn thức uống và kho lạnh tổng hợp.
Theo Thư viện Y khoa Quốc gia Hoa Kỳ, việc tiếp xúc với hàm lượng amoniac thấp là phổ biến và bao gồm việc sử dụng amoniac trong nhà, trong trang trại thông qua phân bón và tại nơi làm việc nếu cơ sở sử dụng hóa chất có chứa amoniac. Tiếp xúc với nồng độ amoniac cao có thể nguy hiểm, gây tích tụ chất lỏng trong phổi và bỏng mắt, cổ họng và da. Nuốt phải amoniac sẽ làm bỏng miệng, cổ họng và dạ dày và có thể gây đau bụng cấp tính. Tiếp xúc trực tiếp với da có thể gây bỏng, phồng rộp và viêm da. Tiếp xúc trực tiếp vào mắt có thể gây kích ứng hoặc tổn thương giác mạc, viêm kết mạc và mù tạm thời hoặc vĩnh viễn.