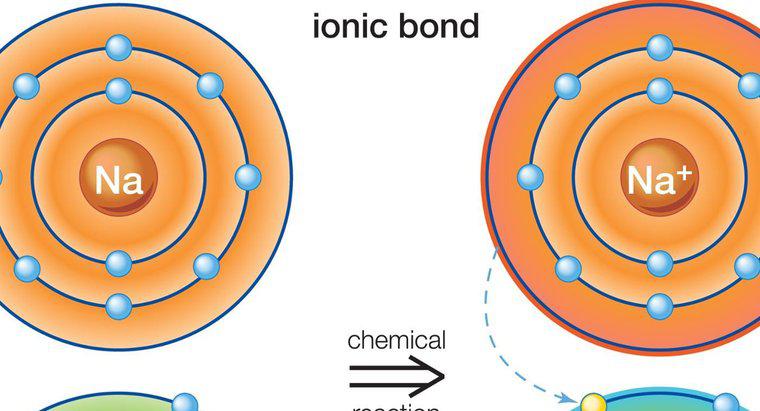
Các hợp chất ion dẫn điện khi hòa tan trong nước do sự chuyển động của các phần tử mang điện tích âm và tích điện dương của chúng tạo thành dòng điện, About.com giải thích. Ở trạng thái lỏng này, các ion tích điện phân tách và chuyển động tự do, tạo ra một dòng điện có chức năng dẫn điện.
Độ dẫn điện đo khả năng của một chất tạo ra dòng điện, trong khi điện năng là chuyển động của các hạt mang điện tạo thành dòng điện đó. Dòng điện, trong lĩnh vực điện, chỉ đơn giản là một dòng điện tích yêu cầu chuyển động tự do. Để hình thành dòng điện, phải có cả chuyển động và dẫn điện. Các hợp chất ion được hình thành khi các ion tích điện dương và âm liên kết chặt chẽ với nhau. Các ion này là những nguyên tử đã nhận được hoặc mất đi một điện tử, và chúng kết hợp với nhau bằng cách chuyển một điện tử trong một quá trình gọi là liên kết ion. Ion mang điện tích dương là cation, trong khi ion mang điện tích âm là anion. Một ví dụ về hợp chất ion là Natri Clorua, NaCl, trong đó Natri (NA) là cation và Clo (Cl) là anion.Các hợp chất ion ở trạng thái rắn của chúng có các hạt được giữ chặt chẽ với nhau, hạn chế mọi chuyển động và ngăn cản dòng điện hình thành. Do đó, chất rắn ion không dẫn điện. Khi hòa tan trong nước, liên kết ion bị phá vỡ, điều này cho phép các ion tích điện được tách ra và chảy tự do. Nước cung cấp chuyển động của các hạt và các ion được tách ra cung cấp độ dẫn điện. Vì cả hai đều có mặt, nên một dòng điện được tạo ra để dẫn điện.