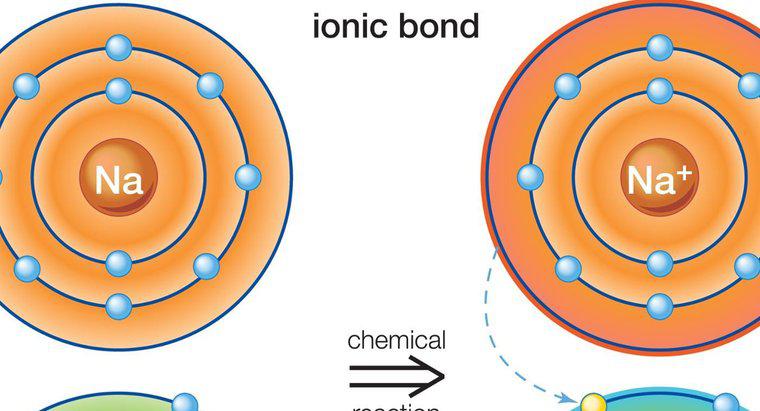
Liên kết ion là một loại liên kết hóa học được thiết lập giữa hai nguyên tử bằng cách chuyển các điện tử hóa trị từ nguyên tử này sang nguyên tử khác. Loại liên kết này còn được gọi là liên kết điện hóa hoặc liên kết cực. Muối là một ví dụ điển hình về các chất được tạo ra bằng liên kết ion.
Một liên kết ion bao gồm một kim loại và một nguyên tử phi kim. Mọi nguyên tử đều có xu hướng đạt được cấu hình electron ổn định, nghĩa là đạt được số octet (2 hoặc 8) cho lớp vỏ hóa trị của nó. Nguyên tử kim loại có số electron dư thừa trên số octet trong lớp vỏ hóa trị của nó. Mặt khác, nguyên tử phi kim thiếu electron và do đó cần electron để hoàn thành octet của nó. Khi chúng đến gần nhau, nguyên tử kim loại nhường các electron dư thừa của nó cho nguyên tử phi kim. Kết quả của sự chuyển electron này, mỗi nguyên tử đều đạt được cấu hình electron ổn định. Hợp chất được hình thành bởi liên kết này được gọi là hợp chất ion hoặc hợp chất điện hóa. Trong liên kết ion, điện tích thực của hợp chất phải bằng không. Một số ví dụ về các hợp chất ion là: NaCl (natri clorua), MgO (magie oxit), CaF2 (canxi florua) và Al2O2 (nhôm oxit). Trong thế giới thực, các hợp chất có liên kết ion thuần túy không được biết là tồn tại. Tất cả các hợp chất ion đều có mức độ liên kết cộng hóa trị.