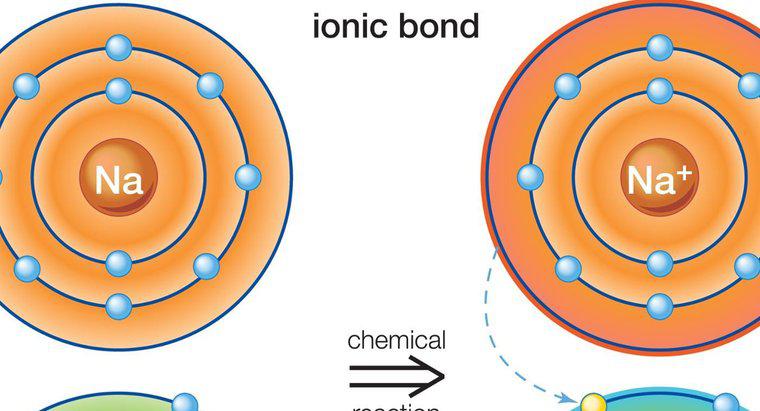
Hợp chất ion hình thành khi các electron chuyển từ nguyên tử này sang nguyên tử khác. Các hợp chất cộng hóa trị hình thành khi các nguyên tử chia sẻ điện tử, dẫn đến không có sự mất mát hoặc thu được điện tử thuần như trong các hợp chất ion.
Khi hai hoặc nhiều nguyên tố hóa học khác nhau kết hợp với nhau, chúng sẽ tạo thành một hợp chất. Làm thế nào các nguyên tử đó kết hợp hoặc liên kết với nhau phụ thuộc vào nguyên tố và đặc điểm của nó. Liên kết giữ các nguyên tử lại với nhau xác định loại hợp chất đó là hợp chất và chúng có thể là ion hoặc cộng hóa trị.
Khái niệm cơ bản về liên kết Nguyên tử được phân loại và đặc trưng bởi số lượng electron mà chúng chứa. Mỗi nguyên tố có một số electron khác nhau nằm trong các obitan đi xung quanh hạt nhân. Quỹ đạo bên ngoài được gọi là quỹ đạo hóa trị, và các điện tử này là những điện tử được sử dụng trong quá trình liên kết. Mỗi nguyên tử tìm cách có một quỹ đạo ngoài cùng đầy đủ của các electron để có thể ổn định. Đối với hầu hết các nguyên tử, quỹ đạo ngoài cùng này chứa tám electron. Quy tắc octet đề cập đến yêu cầu của các điện tử để đạt được, mất hoặc chia sẻ các điện tử để lấp đầy quỹ đạo bên ngoài. Khi các nguyên tử giành được hoặc tặng electron cho một nguyên tố khác, chúng tạo thành các hợp chất ion. Khi các nguyên tử chia sẻ electron với một nguyên tố khác, chúng tạo thành các hợp chất cộng hóa trị.
Hợp chất ion
Hợp chất ion hình thành giữa kim loại và phi kim. Các kim loại thường có ít electron hóa trị ở quỹ đạo ngoài cùng trong khi phi kim có nhiều. Kim loại đóng vai trò là chất cho và chuyển các electron hóa trị của nó cho phi kim, do đó thỏa mãn quy tắc octet cần thiết để tạo thành một nguyên tử bền vững. Điều này dẫn đến một nguyên tử kim loại tích điện dương và một nguyên tử phi kim mang điện tích âm, được gọi là ion. Vì các điện tích trái dấu, hai ion bị hút vào nhau và ở gần nhau, do đó tạo thành một hợp chất ion. Nhiều hơn một điện tử có thể được chuyển trong quá trình này. Bởi vì các nguyên tử mang điện đang trôi nổi tự do, chúng bị hút bởi các nguyên tử khác mang điện tích trái dấu, không chỉ nguyên tử đơn lẻ mà chúng cho hoặc nhận electron.
Hợp chất cộng hóa trị
Ngược lại, các hợp chất cộng hóa trị thường xảy ra giữa các phi kim hoặc hai nguyên tử của các nguyên tố giống nhau hoặc tương tự. Các nguyên tử có độ âm điện tương tự, có thể được xác định từ bảng tuần hoàn, có xu hướng hút nhau và hình thành liên kết cộng hóa trị. Thay vì chuyển hoàn toàn các điện tử hóa trị, các nguyên tử chia sẻ các điện tử ngoài cùng để thỏa mãn quy tắc octet. Các electron dùng chung có thể di chuyển qua lại giữa các nguyên tử liên kết. Không nguyên tử nào được thêm hoặc mất một điện tử trong loại liên kết này, vì vậy không có ion nào được hình thành. Do đó, các nguyên tử trong hợp chất không bị hút bởi các nguyên tử khác gần đó như những nguyên tử được thấy trong các hợp chất ion.
Các hợp chất cộng hóa trị có thể là chất rắn, chất lỏng hoặc chất khí. Chúng có xu hướng dẫn điện kém và có nhiệt độ nóng chảy và sôi thấp. Chúng có xu hướng hòa tan trong chất lỏng không phân cực nhưng không hòa tan trong nước. Một số ví dụ phổ biến về các hợp chất cộng hóa trị là metan (CH4) và carbon dioxide (CO2).