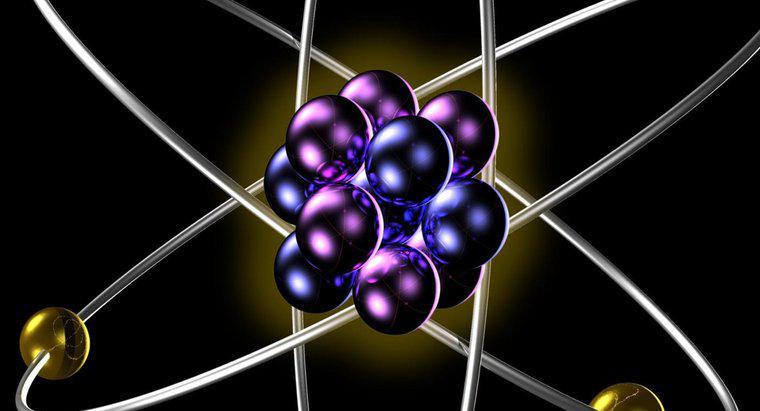
Các đồng vị của cùng một nguyên tố có cùng số proton và electron khi ở dạng nguyên tử trung hòa. Các đồng vị khác nhau có số nơtron khác nhau trong hạt nhân của chúng, dẫn đến trọng lượng nguyên tử khác nhau cho các đồng vị khác nhau của một phần tử duy nhất.
Số proton trong hạt nhân nguyên tử của một nguyên tố cho biết khối lượng nguyên tử của nguyên tố này. Khối lượng nguyên tử là không đổi đối với mọi đồng vị của nguyên tố. Bởi vì khối lượng nguyên tử xác định số lượng các electron phải quay quanh hạt nhân để nguyên tử là trung hòa, khối lượng nguyên tử này xác định hành vi hóa học của nguyên tố, vì tất cả các hóa học phi hạt nhân là kết quả tương tác của các đám mây electron của nguyên tử với một nữa. Điều này có nghĩa là tất cả các đồng vị của cùng một nguyên tố đều tham gia phản ứng hóa học theo cách giống nhau.
Một sự khác biệt trong hành vi đồng vị phát sinh khi hạt nhân của một số đồng vị nhất định không ổn định do sự mất cân bằng về số lượng proton và neutron trong hạt nhân. Nên có khoảng một nơtron cho mỗi proton để hạt nhân nguyên tử có thể ổn định. Khi số lượng neutron tăng không tương xứng với số proton, hạt nhân trở nên không ổn định, làm giảm trọng lượng neutron dư thừa này dưới dạng các hạt alpha và beta và bức xạ gamma.