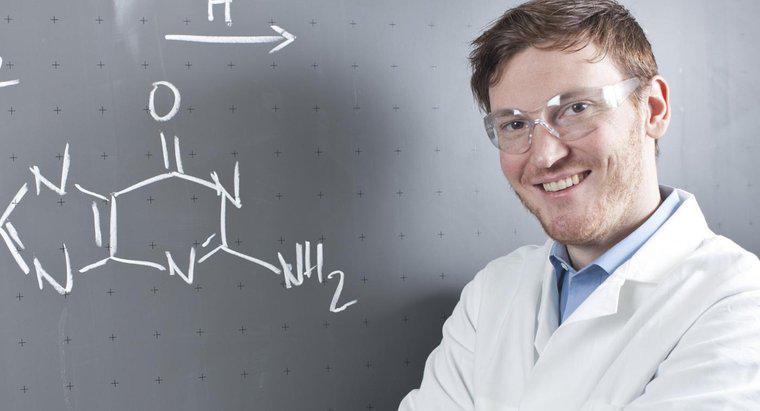
Một mũi tên chỉ theo cả hai hướng trong một phương trình hóa học cho thấy rằng phản ứng là thuận nghịch và có thể tiến hành theo cả hai hướng. Điều này có nghĩa là các chất phản ứng ở phía bên trái cũng là sản phẩm của những người ở bên phải và ngược lại.
Sẽ không đúng khi viết phản ứng thuận nghịch dưới dạng hai phương trình hóa học riêng biệt (mỗi phương trình cho một phương) vì các sản phẩm luôn phản ứng và trở lại thành chất phản ứng ban đầu. Vì cả hai phản ứng xảy ra đồng thời nên hệ hóa học ở trạng thái thay đổi cho đến khi đạt đến trạng thái cân bằng. Điều này có nghĩa là có một điểm mà nồng độ của mỗi chất phản ứng không đổi và không thay đổi theo thời gian. Tuy nhiên, điều này không có nghĩa là mọi chất phản ứng đều có tỷ lệ bằng nhau.
Tốc độ phản ứng và hệ số phản ứng của mỗi chất phản ứng quyết định lượng chất đó được tạo ra và tốc độ nhanh như thế nào. Bởi vì một số phản ứng xảy ra nhanh hơn và cần một lượng lớn hơn chất phản ứng này so với chất phản ứng khác, chúng không có mặt với lượng chẵn khi hệ đạt trạng thái cân bằng. Trong hệ thống cân bằng động, tốc độ phản ứng cho cả hai vế của phương trình là hoàn toàn giống nhau, do đó nồng độ của chất phản ứng và sản phẩm không đổi mặc dù cả hai phản ứng tiếp tục diễn ra vô thời hạn.